前核期受精卵作製のための体外受精
材料
- 生理食塩水(大塚製薬 日本薬局方 大塚生食注)
- CARD HyperOva®(九動株式会社 fertiup(at)kyudo.co.jp)
- hCG(あすか製薬 注射用胎盤性性腺刺激ホルモン 動物用ゴナトロピン 3000単位/管)
- 1mLシリンジ(テルモ SS-01T2613S)
- FERTIUP®-精子前培養培地(九動株式会社 fertiup(at)kyudo.co.jp)
- CARD MEDIUM(九動株式会社 fertiup(at)kyudo.co.jp)
- mHTF
- オートピペッター(GILSON PIPETMAN P-200 P-20)
- イエローチップ(ビーエム機器 Cat.No.110-96R)
- 媒精用チップ(Quality Scientific Plastics Pipet Tip Cat.No.114)
- 流動パラフィン(ナカライテスク Cat.No.26137-85)
- ディッシュ(コーニング 35mm X 10mm Cat.No.430588)
- ハサミ 大 解剖用(夏目製作所 反剪刀 Cat.No.B-2)
- ハサミ 小 解剖用(夏目製作所 小直剪刀 Cat.No.B-12)
- ピンセット 大 解剖用(夏目製作所 先細無鈎ピンセット Cat.No.A-5)
- ピンセット 小 解剖用(夏目製作所 尖鋭ピンセット Cat.No.A-45)
- ノエス剪刀(森田製作所 TEL 03-3811-9730 特注品)
- 解剖針(夏目製作所 ブローチホルダー Cat.No.E-14)
- 濾紙
- キャピラリー
- 倒立顕微鏡
- CO2インキュベーター(37°C 5% CO2 95% air)
方法
過排卵処理
1 hCGを、37.5単位/mLとなるように生理食塩水に溶かす。*hCG溶液は、4°Cで約2週間保存可能である。
2 成熟雌マウスまたは幼若雌マウス(誕生日を0とし、25~31日目)に、CARD HyperOva®を0.2mL/匹、その48時間後にhCGを0.2mL/匹 腹腔内投与することにより、過排卵処理を施す(通常、誘発剤およびhCGの投与は午後5~6時に行う)。
*幼若雌マウスを使用する時は、体重が14~18gのものを使用する。
ドロップの準備
1 以下の手順で培養液のドロップ(a, b, c)を作製してCO2インキュベーター内で静置し、ガス平衡させる。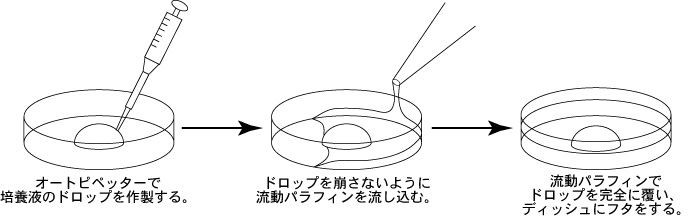
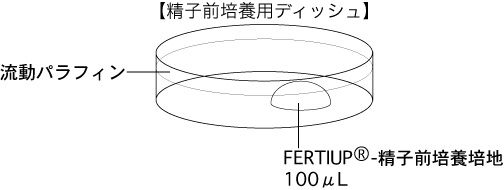
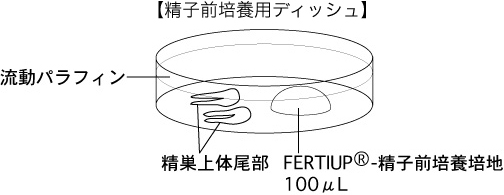
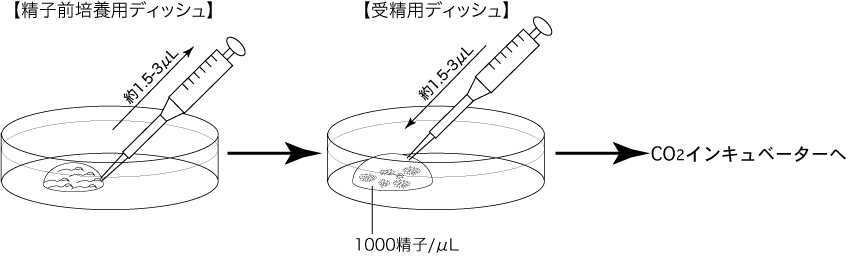
a 精子を採取する30分前に、精子前培養用ディッシュ(100µLのFERTIUP®-精子前培養培地ドロップ1個)を作製し、インキュベーター内に静置しておく。
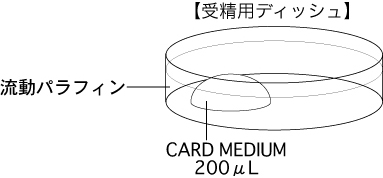
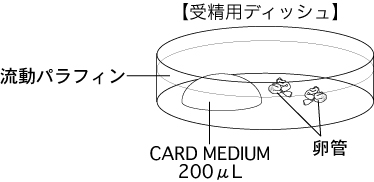
b 採卵10分前に、受精用ディッシュ(200µLのCARD MEDIUMドロップ1個)を作製し、インキュベータ内に静置する。
*体外受精にどのような精子を用いるかで、CARD MEDIUMの調整方法が異なる。取扱説明書を参照すること。
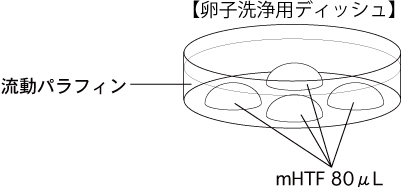
c 卵子洗浄用ディッシュ(80µLのmHTFドロップ4個)を作製し、インキュベーター内で30分以上静置する。
精子の採取
全ての解剖器具をアルコール消毒する。1 1~2匹の成熟雄マウス(3ヶ月~6ヶ月齢)を安楽死させ、ハサミ(大)・ピンセット(大)を用いて精巣上体、精巣および脂肪の一部を取り出し、濾紙上で精巣上体尾部のみを切り取り、血液や脂肪を除去する。
2 切り出した精巣上体尾部を、精子前培養用ディッシュの流動パラフィン中に入れる。
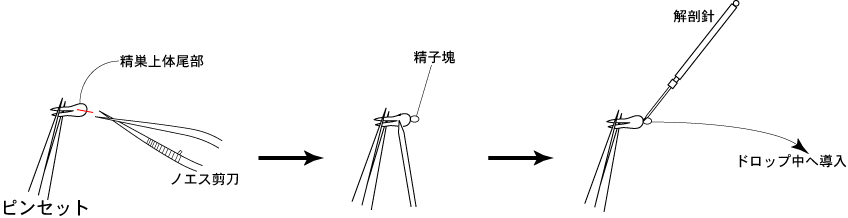
3 ピンセット(小)で精巣上体尾部を固定し、ノエス剪刀で尾部中央の精巣上体管を切開する。
4 解剖針で精巣上体尾部の表面を軽く押さえることにより、精巣上体管切開部から精子塊を押し出す。
5 露出した精子塊を解剖針ですくい取り、FERTIUP®-精子前培養培地のドロップに導入する。
*精子前培養培地のドロップ中で、すくい取った精子塊が解剖針の先から離れないときは、解剖針をもう一本使って精子塊をやさしく引き剥がすようにする。
[精巣上体尾部からの精子採取]
6 精子塊をFERTIUP®-精子前培養培地に導入し、CO2インキュベーター内(37°C 5% CO2 95% air)で60分間前培養する。
卵子の採取
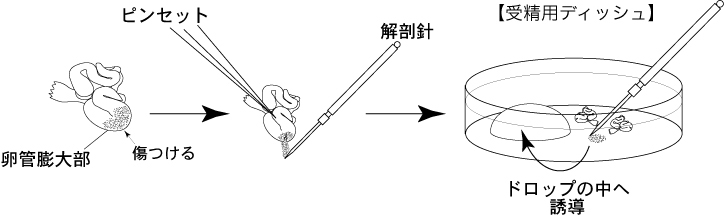
全ての解剖器具をアルコール消毒する。1 過排卵処理を施した雌マウスをhCG投与15~17時間後に安楽死させ、卵管のみを切り出し、濾紙上で血液や脂肪を除去する。
2 卵管を、受精用ディッシュ内の流動パラフィン中に沈める。
3 ピンセットで卵管をディッシュの底に押しつけることにより固定し、解剖針で膨大部の卵管壁を引き裂き、放出した卵子塊をCARD MEDIUMのドロップ(200µL)に導入する。
採取した卵管を室温以上の温度域に3分以上放置しておくと、卵子の受精および発生能が著しく低下してしまうため、雌の安楽死から、卵管を採取・卵子塊を受精用CARD MEDIUMドロップに導入するまでの操作は、極力短時間で行う(30秒以内)。
1人で行う場合は、一度に複数の雌を安楽死させるのではなく、1匹ずつ安楽死させ、すばやく採卵する。
幼若雌マウスを使用する場合は、1つのCARD MEDIUMドロップに1匹分(2個)の卵子塊を導入する。
成熟雌マウスを使用する場合は、1つのCARD MEDIUMドロップに2〜3匹分(4〜6個)の卵子塊を導入する。
1人で行う場合は、一度に複数の雌を安楽死させるのではなく、1匹ずつ安楽死させ、すばやく採卵する。
幼若雌マウスを使用する場合は、1つのCARD MEDIUMドロップに1匹分(2個)の卵子塊を導入する。
成熟雌マウスを使用する場合は、1つのCARD MEDIUMドロップに2〜3匹分(4〜6個)の卵子塊を導入する。
4 採卵後、受精用ディッシュをCO2インキュベーター内に静置し、20~40分間培養する。
媒精
1 前培養した精子を倒立顕微鏡で観察し、良好な運動能および濃度を有している精子のディッシュを媒精に用いる。2 チップ(Pipette Tip Cat.No.114 Quality Scientific Plastics)を用いて、前培養した精子懸濁液 約1.5〜3µLを吸引し、卵子を含む受精用ディッシュのCARD MEDIUMドロップに添加する(媒精)。
*受精用ドロップに導入した卵塊の大きさおよび予想される卵数に応じてドロップ゙ごとに媒精量を決定する。
約100個の卵子/ドロップの場合、精子懸濁液 約1.5〜3µLを受精用ドロップに添加し、精子濃度が約1000精子/µL程度になるよう媒精する。
3 受精用ディッシュをCO2インキュベーター内(37°C 5% CO2 95% air)で培養する。
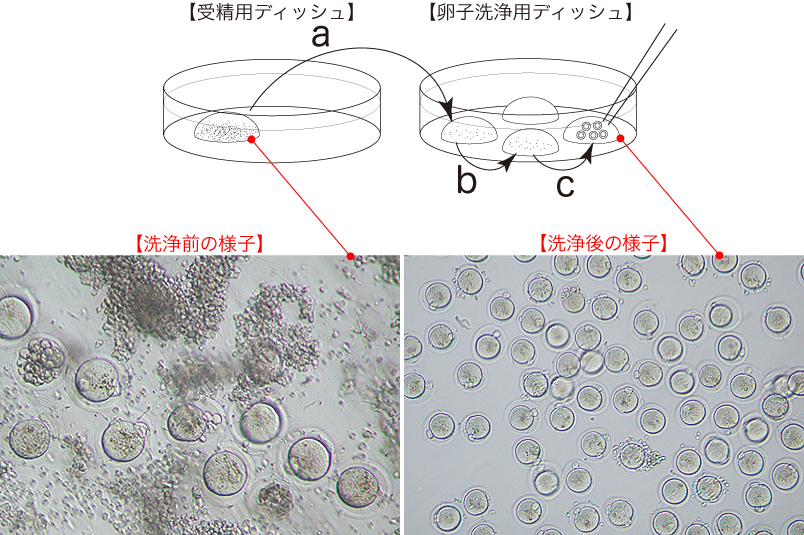
4 媒精から2.5時間後、形態的に正常な卵子のみをガラスキャピラリーで吸引し、新しい卵子洗浄用ディッシュのmHTFドロップに移して(a→b→c)、洗浄をおこなう。
*洗浄の際は、極力、CARD MEDIUMを卵子洗浄用ディッシュのドロップに持ち込まないように注意する。
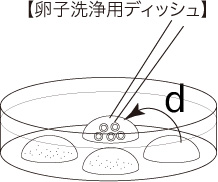
5 媒精から6~6.5時間後、卵子をよく観察し、第二極体をもつ卵子を残りのドロップに移す(d)。第二極体については、こちらのページを参照。
*前核が明確に確認できない場合は、卵子を凍結-融解した後に再度観察し受精した卵子を選択する。
6 得られた第二極体放出卵子を凍結保存に用いる。
参考文献
- Nakagawa Y., Sakuma T., Nakagata N., Yamasaki S., Takeda N., Ohmuraya M., Yamamoto T. 2014 Application of Oocyte Cryopreservation Technology in TALEN-Mediated Mouse Genome Editing. Exp. Anim. 63(3): 349-355.
- Nakagawa Y., Sakuma T., Sakamoto T., Ohmuraya M., Nakagata N., Yamamoto T. 2015 Production of knockout mice by DNA microinjection of various CRISPR/Cas9 vectors into freeze-thawed fertilized oocytes. BMC Biotechnol. 2015 15:33.
- Nakagawa Y., Sakuma T., Nishimichi N., Yokosaki Y., Yanaka N., Takeo T., Nakagata N., Yamamoto T. 2016 Ultra-superovulation for the CRISPR-Cas9-mediated production of gene-knockout, single-amino-acid-substituted, and floxed mice. Biol Open. 5(8): 1142-1148.
- Nakagawa Y., Sakuma T., Nishimichi N., Yokosaki Y., Takeo T., Nakagata N., Yamamoto T. 2017 Culture time of vitrified/warmed zygotes before microinjection affects the production efficiency of CRISPR-Cas9-mediated knock-in mice. Biol Open. 6(5): 706-713.
更新履歴
- 新規: 2017.09.04
CARD MEDIUMの使用により未受精卵子の透明帯が脆弱化され精子が透明帯を通過しやすくなり体外受精率の向上が期待できる一方で、体外受精後の卵子の凍結-融解を行うためのピペッティング操作により卵子がダメージを受ける可能性が高まる。そのため、CARD MEDIUMを適正な手順(濃度)で準備することが肝要となる。
さらに、大量の精子が脆弱化した透明帯を通過するときに透明帯へ与えるダメージを抑制するため、媒精に用いる精子量を調整することも重要である。




