未受精卵子の凍結・融解方法
材料
- 過排卵処理した雌マウス
- ディッシュ(コーニング 35mm X 10mm Cat.No.430588)
- 流動パラフィン(ナカライテスク Cat.No.26137-85)
- オートピペッター(GILSON PIPETMAN P-20)
- イエローチップ(ビーエム機器 Cat.No.110-96R)
- mHTF
- 1% ヒアルロニダーゼ溶液
- 牛胎仔血清(Gibco Fetal Bovine Serum(FBS) Cat.No.26140-087)
- ディスポーザブル・フィルターユニット(ミリポア ポアサイズ:0.22µm Cat.No.SLGVJ13SL)
- 2.5mLシリンジ(テルモ Cat. No.SS-02SZ)
- キャピラリー
- CO2インキュベーター(37°C 5% CO2 95% air)
- 簡易ガラス化による胚の凍結・融解方法と同じ器具・培地を用いる。
(凍結未受精卵子の融解後の洗浄には、mHTFを用いる)
方法
ディッシュの準備
1 採卵用ディッシュ(200µLのmHTFドロップ1個)を作製し、インキュベーター内で30分以上静置しておく。
2 卵子洗浄用ディッシュ(80µLのmHTFドロップ4個)を作製し、インキュベーター内で30分以上静置しておく。
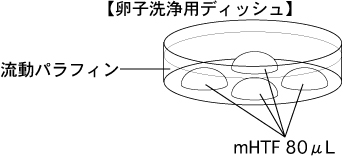
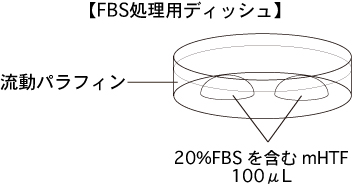
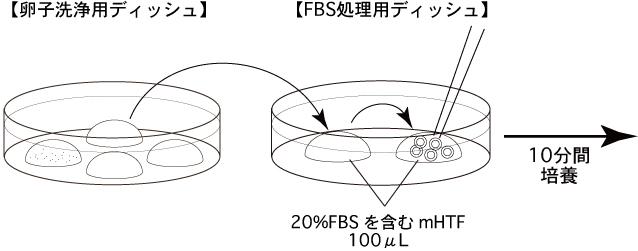
3 20%FBSを含むmHTFを適量作製して濾過滅菌し、FBS処理用ディッシュ(20%FBSを含むmHTFの100µLドロップ2個)を作製して、インキュベーター内で30分以上静置しておく。
卵丘細胞の除去
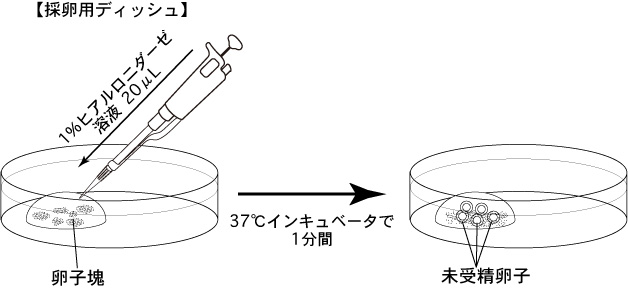
1 採卵用ディッシュの200µLのmHTFドロップに、過排卵処理した雌マウスから卵子塊を採取する(1ドロップあたり5匹分の卵子塊)。*安楽死から、卵管を採取・卵子塊を採卵用ディッシュのmHTFドロップに導入するまでの操作は、極力短時間で行う(30秒以内)。
**1人で行う場合は、一度に複数の雌を安楽死させるのではなく、1匹ずつ安楽死させ、すばやく採卵する。
2 卵子塊を含む200µLのドロップに、オートピペッター(P-20)を用いて1% ヒアルロニダーゼ溶液を20µL添加し、37°Cのインキュベーター内に1分間静置する。
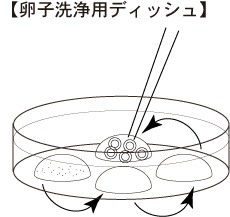
3 卵丘細胞が除去された卵子を、順次、80µLのmHTFドロップ(卵子洗浄用ディッシュ)に移す。
* 37°C 1分間の処理後に卵丘細胞が完全に除去できなくても、洗浄の過程で徐々にはがれていく。

4 卵丘細胞が除去された卵子を、卵子洗浄用ディッシュ内のmHTFドロップで、3回洗浄する。
牛胎仔血清(FBS)による処理
1 未受精卵子を、20%のFBSを含むmHTFのドロップ(FBS処理用ディッシュ)に移して2回洗浄し、10分間培養する。*FBSは、凍結・融解過程に起こる未受精卵子の透明帯硬化を防ぐ働きがある。
未受精卵子の凍結保存
1 卵丘細胞を除去し、FBSを含む培地中で培養した後の未受精卵子の凍結および融解操作は、胚と同様に行う。(凍結未受精卵子の融解後の洗浄には、mHTFを用いる)
凍結-融解後の未受精卵子を用いた体外受精
1 新鮮精子、冷蔵輸送された精巣上体尾部精子および凍結精子を用いた体外受精については、それぞれの方法に準じて行う。ポイント:体外受精に用いる受精用培地(CARD MEDIUM)の調整方法は、使用する精子により異なる。受精用培地の取扱説明書をよく読み、受精用ディッシュの準備を行う。
参考文献
- Nakagata N, Takeo T, Fukumoto K, Kondo T, Haruguchi Y, Takeshita Y, Nakamuta Y, Matsunaga H, Tsuchiyama S, Ishizuka Y, Araki K. 2013. Applications of cryopreserved unfertilized mouse oocytes for in vitro fertilization. Cryobiology. Oct;67(2):188-92.
更新履歴
- 新規: 2014.01.25




