胚の融解
材料
- 0.25 M sucrose
- KSOM/AA
- ディッシュ(コーニング 35mm X 10mm Cat.No.430588)
- ブルーチップ(ビーエム機器 Cat.No.111-R100S)
- キャピラリー
- オートピペッター(GILSON PIPETMAN P-1000)
- 解剖針(夏目製作所 ブローチホルダー Cat.No.E-14)
- アルコールランプ(又は、REKROW 卓上ミニガスバーナー Cat.No.RK4102)
- CO2インキュベーター(37°C 5% CO2 95% air)
方法
胚洗浄用ディッシュとSucrose溶液の準備
1 融解した胚を洗浄するための胚洗浄用ディッシュを作製し、CO2インキュベーター内で30分以上、ガス平衡させる。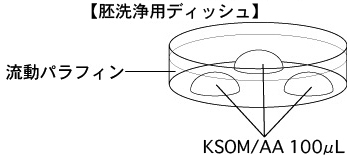
2 CO2インキュベーター(37°C 5% CO2 95% air)内で、0.25 M sucrose溶液を加温しておく。
胚の融解
1 凍結チューブを液体窒素保管器から取り出した後、直ちにフタを開け、チューブ内の液体窒素を捨て、室温に30秒間静置する。2 オートピペッターで、あらかじめ37°Cに加温しておいた0.9mLの0.25 M sucrose溶液をチューブ内へ添加し、完全に保存液が溶けるまですばやくピペッティング(約10回)する。
*融解した保存液は、常温ではきわめて細胞毒性が強いため、0.25 M sucrose溶液をチューブ内へ添加し、すばやくピペッティングすることで、保存液を希釈する。
**ピペッティング
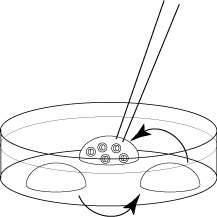
下図のように、1回目のピペッティングで0.9mL の 0.25 M sucrose溶液をすばやくチューブ内に添加して加温する(チップ先端が保存液に触れると、チップ内のsucrose溶液が凍ってチップ先端が詰まってしまう場合があるので注意する)。
2回目以降のピペッティングでは、青矢印のように小幅にピペッティングする。
なお、2回目以降のピペッティングは、胚を壊さないようにゆっくり、かつ、すばやく胚を加温できるようスムーズに行う(ピペッティング自体の速度については、動画を参照のこと)。
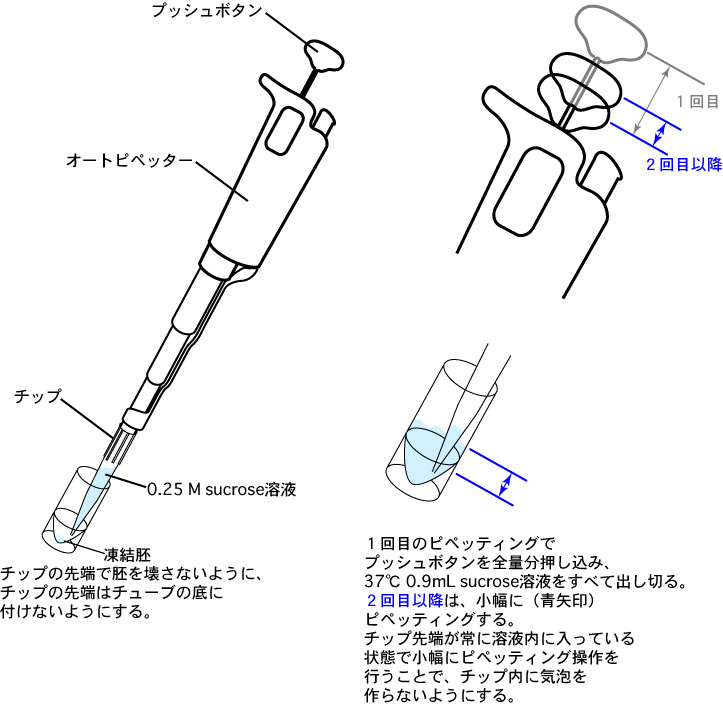
3 オートピペッターを用いて、保存液とsucrose溶液が混じり合った内容液をディッシュに移し、さらに0.4~0.5mLの0.25 M sucrose溶液でチューブ内を共洗いする。
[胚の融解]
ポイント:ピペッティングの際は、極力泡立たせないよ うにする。
なお、内容液をディッシュに移した時、内容液表面に泡ができた場合は、胚を回収す るのにじゃまになるため、アルコールランプなどで熱した解剖針の先を泡に触れさせ、 消失させる。
なお、内容液をディッシュに移した時、内容液表面に泡ができた場合は、胚を回収す るのにじゃまになるため、アルコールランプなどで熱した解剖針の先を泡に触れさせ、 消失させる。
[胚の融解時のピペッティング]
ポイント:ピペッティング中にチップ内に空気の泡を入れてしまうと、内容液をディッシュに移したときに、内容液表面にたくさんの空気の泡ができてしまうため、顕微鏡で胚を確認することが困難となり、融解した胚の回収ができなくなってしまうので注意する。
4 融解後ただちに内容液より胚を回収し、あらかじめ(洗浄30分以上前)作製しておいた胚洗浄用ディッシュのKSOM/AAドロップ(100µL)に静かに導入し、インキュベーター内で10分間静置する。
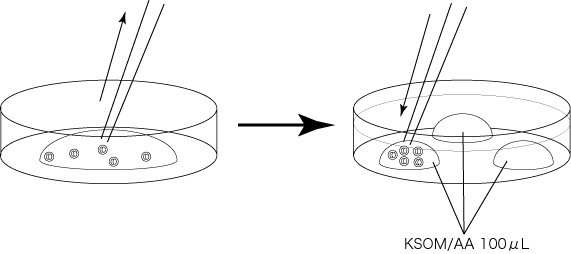
[10分間静置後]

5 残りのKSOM/AAドロップで2回洗浄する。
参考文献
Nakao K., Nakagata N., and Katsuki M. 1997. Simple and effcient procedure for cryopreservation of mouse embryos by simple vitrification. Exp. Anim. 46: 231-234.更新履歴
- 更新 : 2012.10.06 凍結された胚盤胞期胚の融解後に、KSOM/AAドロップで30分間静置する記述を削除しました。2細胞期胚と同様に、10分間の静置で問題ないためです。




