前核期受精卵の凍結
材料
- 前核期受精卵
- 1M DMSO
- DAP213
- ディッシュ(コーニング 35mm X 10mm Cat.No.430588)
- ディスポーザブル・フィルターユニット(ミリポア ポアサイズ:0.22µm Cat.No.SLGVJ13SL)
- 2.5mLシリンジ(テルモ Cat. No.SS-02SZ)
- イエローチップ(ビーエム機器 Cat.No.110-96R)
- ゲルローディングチップ(ビーエム機器 Cat.No.010-R204S)
- キャピラリー
- オートピペッター(GILSON PIPETMAN P-20 P-100)
- 凍結用チューブ(SUMILON 1.2mLセラムチューブ インナーキャップ Cat.No.MS-4501W)
- クライオカラーコード(NUNC クライオカラーコードミックス Cat.No.375930)
- ケーン(マイサイエンス アンプルケーン Cat.No.C-7)
- ケーン用スリーブ(NUNC Cat.No.5016-0001)
- ラブトップクーラー(ナルゲン Cat.No.5116-0012)
方法
ラブトップクーラーの準備
1 ラブトップクーラーを、受精卵凍結の前日から冷凍庫(-20°C)で冷却し、使用前に冷凍庫から取り出す。2 10分後、凍結用チューブをラブトップクーラーに立てる。
*ラブトップクーラーは、冷凍庫から取り出してから約1時間、0°C付近の温度域を保っている。従って、その時間内に受精卵の凍結保存を終了するようにする。
前核期受精卵の凍結保存
1 室温にて1M DMSOのドロップ(約100µL)を作製する。1M DMSOは、ディスポーザブル・フィルターユニットを用いて使用直前に濾過する。ドロップの数は凍結するチューブの本数の2倍とする(例えば、凍結するチューブが2本であれば、4個のドロップを作製する)。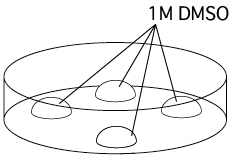
2 約100個の受精卵を1つの1M DMSOのドロップに静かに移す。受精卵がディッシュの底に沈んだら、別の1M DMSOのドロップに受精卵を移す。
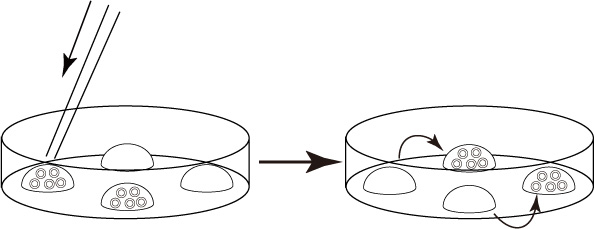
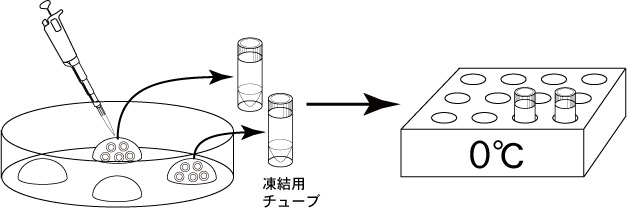
3 オートピペッター(P-20)を用いて、5µLの1M DMSO溶液とともに受精卵を凍結用チューブの底に入れ、0°Cのラブトップクーラーに移す。
ポイント:ディッシュを前後左右に軽く揺することで、受精卵をドロップの中央に集めてから、受精卵にチップの先端を近づけ、オートピペッターでいっきに吸引する。また、チューブに受精卵を移した後、チップを1M DMSOのドロップ内でピペッティングして、チップ内に受精卵が残っていないことを確認する。
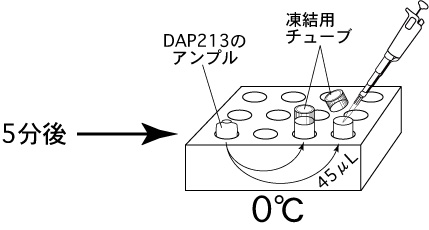
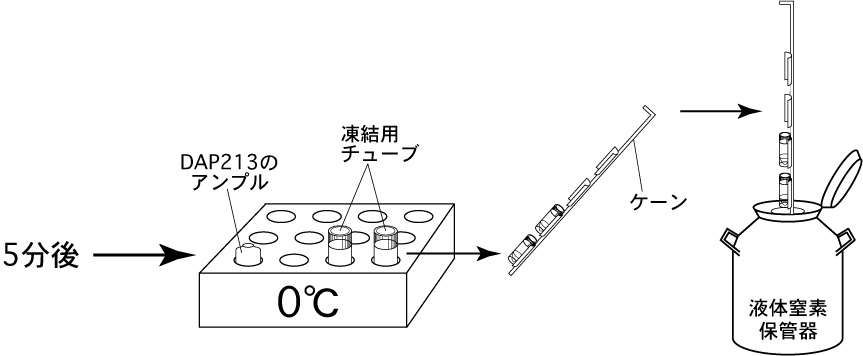
4 5分後、オートピペッター(P-100)を用いて、あらかじめ0°Cに冷却しておいた保存液(DAP213)45µLを、管壁を伝わらせてチューブ内に静かに添加する。
添加したら、チューブのフタを閉める。
5 更に5分後、液体窒素内で冷却しておいたケーンにチューブを装着し、直ちに液体窒素中に浸漬する。
* フタは、融解時、直ちに開けなければならないため、ゆるめにしておく。
前核期受精卵の融解
1 2細胞期胚の融解と同様の方法で操作を行う。参考文献
- Nakagawa Y., Sakuma T., Nakagata N., Yamasaki S., Takeda N., Ohmuraya M., Yamamoto T. 2014 Application of Oocyte Cryopreservation Technology in TALEN-Mediated Mouse Genome Editing. Exp. Anim. 63(3): 349-355.
- Nakagawa Y., Sakuma T., Sakamoto T., Ohmuraya M., Nakagata N., Yamamoto T. 2015 Production of knockout mice by DNA microinjection of various CRISPR/Cas9 vectors into freeze-thawed fertilized oocytes. BMC Biotechnol. 2015 15:33
- Nakagawa Y., Sakuma T., Nishimichi N., Yokosaki Y., Yanaka N., Takeo T., Nakagata N., Yamamoto T. 2016 Ultra-superovulation for the CRISPR-Cas9-mediated production of gene-knockout, single-amino-acid-substituted, and floxed mice. Biol Open. 5(8): 1142-1148.
- Nakagawa Y., Sakuma T., Nishimichi N., Yokosaki Y., Takeo T., Nakagata N., Yamamoto T. 2017 Culture time of vitrified/warmed zygotes before microinjection affects the production efficiency of CRISPR-Cas9-mediated knock-in mice. Biol Open. 6(5): 706-713.
更新履歴
- 新規: 2017.09.04
手順は2細胞期胚の凍結-融解方法とほぼ同じだが、超過剰排卵誘発剤により得られた大量の受精卵を処理するため、100個の受精卵をまとめて操作する。
100個の受精卵を1M DMSOのドロップで確実に平衡させるため、2細胞期胚の場合より多くのドロップを使う。
100〜130個の受精卵を1本の凍結チューブで凍結しても問題はない。




