体外受精
材料
- 生理食塩水(大塚製薬 日本薬局方 大塚生食注)
- PMSG(あすか製薬 注射用血清性性腺刺激ホルモン 動物用セロトロピン 1000単位/管)
- hCG(あすか製薬 注射用胎盤性性腺刺激ホルモン 動物用ゴナトロピン 3000単位/管)
- 1mLシリンジ(テルモ SS-01T2613S)
- FERTIUP®-精子前培養培地(九動株式会社 fertiup(at)kyudo.co.jp)
- CARD MEDIUM(九動株式会社 fertiup(at)kyudo.co.jp)
- mHTF
- オートピペッター(GILSON PIPETMAN P-200 P-20)
- イエローチップ(ビーエム機器 Cat.No.110-96R)
- 媒精用チップ(Quality Scientific Plastics Pipet Tip Cat.No.114)
- 流動パラフィン(ナカライテスク Cat.No.26137-85)
- ディッシュ(コーニング 35mm X 10mm Cat.No.430588)
- ハサミ 大 解剖用(夏目製作所 反剪刀 Cat.No.B-2)
- ハサミ 小 解剖用(夏目製作所 小直剪刀 Cat.No.B-12)
- ピンセット 大 解剖用(夏目製作所 先細無鈎ピンセット Cat.No.A-5)
- ピンセット 小 解剖用(夏目製作所 尖鋭ピンセット Cat.No.A-45)
- ノエス剪刀(森田製作所 TEL 03-3811-9730 特注品)
- 解剖針(夏目製作所 ブローチホルダー Cat.No.E-14)
- 濾紙
- キャピラリー
- 倒立顕微鏡
- CO2インキュベーター(37°C 5% CO2 95% air)
方法
過排卵処理
1 ホルモン(PMSGおよびhCG)を、37.5単位/mLとなるように生理食塩水に溶かす。*ホルモン溶液は、4°Cで約2週間保存可能である。
2 成熟雌マウス(8~12週齢)に、PMSGおよびhCGを0.2mL(7.5単位)/匹 48時間間隔で腹腔内投与することにより、過排卵処理を施す(通常、ホルモン投与は午後5~6時に行う)。
ドロップの準備
1 以下の手順で培養液のドロップ(a, b, c)を作製してCO2インキュベーター内で静置し、ガス平衡させる。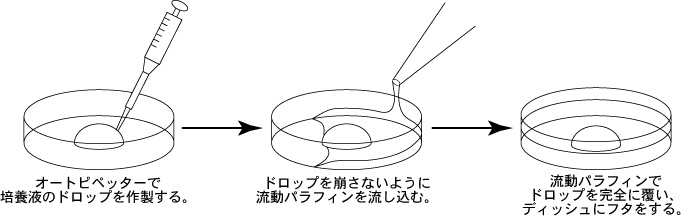
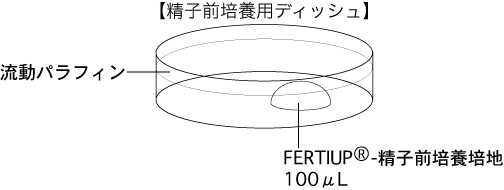
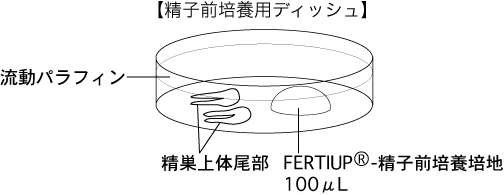
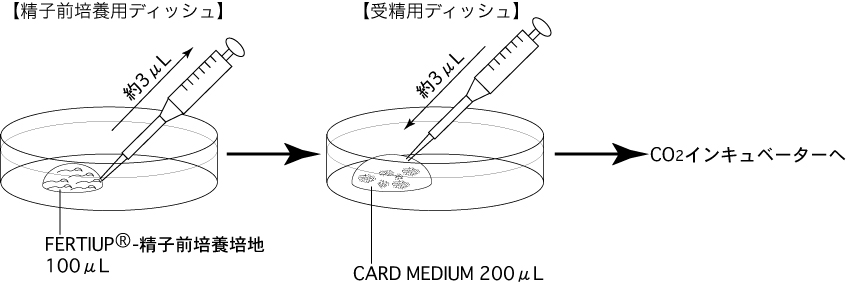
a 精子を採取する30分前に、精子前培養用ディッシュ(100µLのFERTIUP®-精子前培養培地ドロップ1個)を作製し、インキュベーター内に静置しておく。
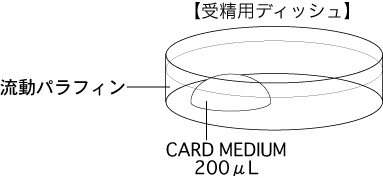
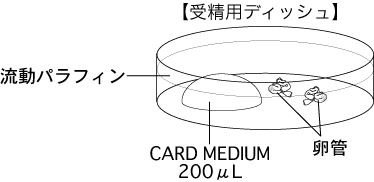
b 採卵10分前に、受精用ディッシュ(200µLのCARD MEDIUMドロップ1個)を作製し、インキュベータ内に静置する。
*体外受精にどのような精子を用いるかで、CARD MEDIUMの調整方法が異なる。取扱説明書を参照すること。
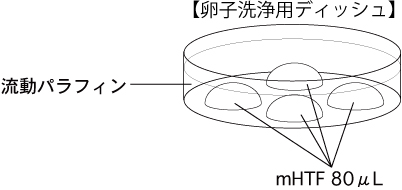
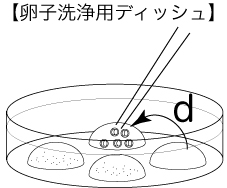
c 卵子洗浄用ディッシュ(80µLのmHTFドロップ4個)を作製し、インキュベーター内で30分以上静置する。
精子の採取
全ての解剖器具をアルコール消毒する。1 1~2匹の成熟雄マウス(3ヶ月~6ヶ月齢)を安楽死させ、ハサミ(大)・ピンセット(大)を用いて精巣上体、精巣および脂肪の一部を取り出し、濾紙上で精巣上体尾部のみを切り取り、血液や脂肪を除去する。
2 切り出した精巣上体尾部を、精子前培養用ディッシュの流動パラフィン中に入れる。
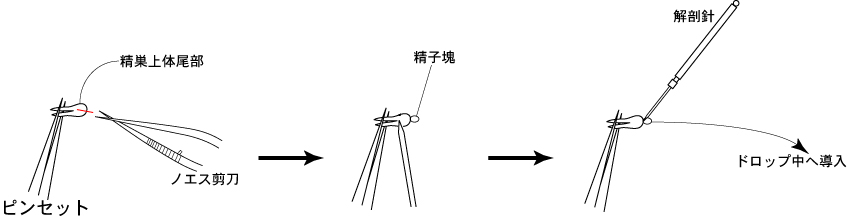
3 ピンセット(小)で精巣上体尾部を固定し、ノエス剪刀で尾部中央の精巣上体管を切開する。
4 解剖針で精巣上体尾部の表面を軽く押さえることにより、精巣上体管切開部から精子塊を押し出す。
5 露出した精子塊を解剖針ですくい取り、FERTIUP®-精子前培養培地のドロップに導入する。
*精子前培養培地のドロップ中で、すくい取った精子塊が解剖針の先から離れないときは、解剖針をもう一本使って精子塊をやさしく引き剥がすようにする。
[精巣上体尾部からの精子採取]
6 精子塊をFERTIUP®-精子前培養培地に導入し、CO2インキュベーター内(37°C 5% CO2 95% air)で60分間前培養する。
卵子の採取
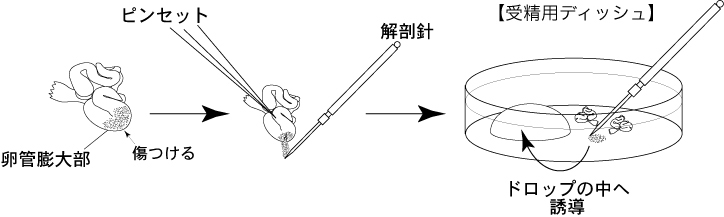
全ての解剖器具をアルコール消毒する。1 過排卵処理を施した雌マウスをhCG投与15~17時間後に安楽死させ、子宮、卵管、卵巣および脂肪の一部を取り出し、濾紙上で卵管のみを切り取り、血液や脂肪を除去する。
2 卵管を、受精用ディッシュ内の流動パラフィン中に沈める。
3 ピンセットで卵管をディッシュの底に押しつけることにより固定し、解剖針で膨大部の卵管壁を引き裂き、放出した卵子塊をCARD MEDIUMのドロップ(200µL)に導入する。
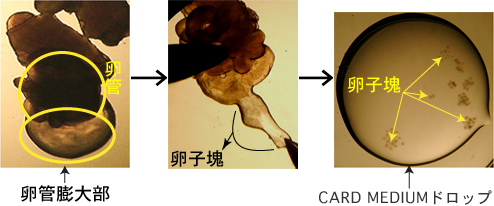
採取した卵管を室温以上の温度域に3分以上放置しておくと、卵子の受精および発生能が著しく低下してしまうため、雌の安楽死から、卵管を採取・卵子塊を受精用CARD MEDIUMドロップに導入するまでの操作は、極力短時間で行う(30秒以内)。
1人で行う場合は、一度に複数の雌を安楽死させるのではなく、1匹ずつ安楽死させ、すばやく採卵する。
1人で行う場合は、一度に複数の雌を安楽死させるのではなく、1匹ずつ安楽死させ、すばやく採卵する。
4 採卵後、受精用ディッシュをCO2インキュベーター内に静置し、30~60分間培養する。
媒精
1 チップ(Pipette Tip Cat.No.114 Quality Scientific Plastics)を用いて、前培養した精子懸濁液 約3µLを吸引し、卵子を含む受精用ディッシュのCARD MEDIUMドロップに添加する(媒精)。2 受精用ディッシュをCO2インキュベーター内(37°C 5% CO2 95% air)で培養する。
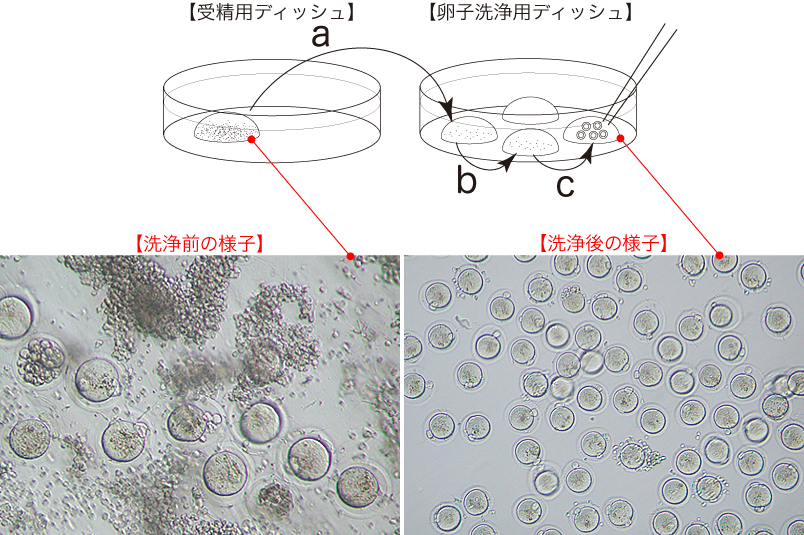
3 媒精から3時間後、形態的に正常な卵子のみをガラスキャピラリーで吸引し、新しい卵子洗浄用ディッシュのmHTFドロップに移して(a→b→c)、洗浄をおこなう。
*洗浄の際は、極力、CARD MEDIUMを卵子洗浄用ディッシュのドロップに持ち込まないように注意する。
**洗浄時に透明帯表面に多数の精子が付着している場合は、イエローチップを装着したオートピペッター(20µL)を用いて、受精用ディッシュ内のCARD MEDIUMドロップを20~30回ピペッティングした後、卵子の洗浄を行う。
4 媒精から約6時間後、卵子をよく観察し、単為発生卵と判定されたもの(卵細胞質内に1つの前核のみが認められるもの)を取り除き、翌日まで培養する。
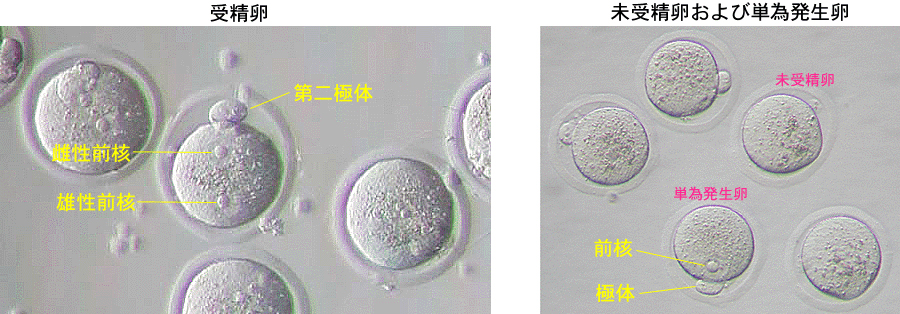
* 受精卵は、第二極体および雌雄前核が認められるが(写真左)、単為発生卵は1つの前核のみであり(写真右)、未受精卵は前核がまったく認められない(写真右)。
5 翌日(媒精24~28時間後)、卵子洗浄用ディッシュの残りのドロップに2細胞期へ発生した胚のみを移し(d)、胚数をカウント後、移植あるいは凍結保存に用いる。
2細胞期胚は胚盤胞期まで体外で培養可能であり、培養を行う際には、KSOM/AAを用いる。
更新履歴
- 新規: 2012.03.13
- 更新: 2016.03.16
精子採取の動画を差し替え。
以前の動画は採取する精子の量が少なかったため、新たに撮影した動画に変更した。




