冷冻精子的体外受精
材料和设备
- 用麦管冷冻的精子
- 用PMSG和hCG超排的母鼠
- FERTIUP®(前培养液:PM;COSMO BIO)
- CARD MEDIUM(COSMO BIO)
- mHTF
- 移液器枪头(QSP pipette tip Cat.No.114 Thermo scientific)
- 塑料培养皿(35mm x 10mm Cat.No.430588; CORNING)
- 麦管连接器
- 维持37℃的水浴箱
- 用于解冻的漂浮物
- 微量移液器
- 二氧化碳培养箱(37℃, 5% CO2, 95% 空气)
程序
解冻用漂浮物的制备
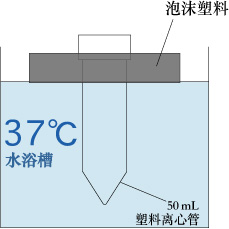
- 利用一些泡沫塑料和1个50mL的塑料离心管按下图所示制作1个漂浮物。

准备解冻
- 准备一个37℃的水浴箱。
- 将纯水(37℃)加入到50mL离心管内至漂浮物高度,使其漂浮在水浴箱中。
-
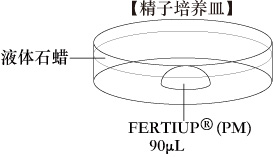
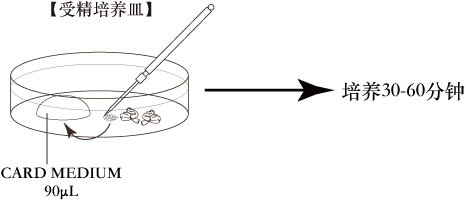
在精子冷冻麦管解冻前30分钟,在培养皿中做一滴(90μL /滴)的FERTIUP®(PM),用石蜡油封面,置于二氧化碳培养箱中(37℃,5% CO2)。
-
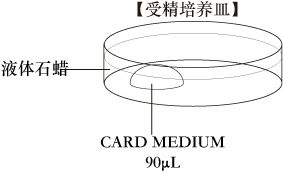
在采集卵母细胞前10分钟,在培养皿中做一滴(90μL /滴)的CARD MEDIUM,用石蜡油封面,置于二氧化碳培养箱中(37℃,5% CO2)。
注意: 有三种不同的方法来准备CARD MEDIUM,这取决于是使用新鲜的、冻融的还是低温冷藏的精子来进行体外受精。
请参阅CARD MEDIUM说明手册。
-
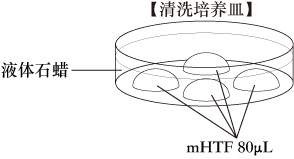
在培养皿里做4滴(80μL/滴)mHTF培养液滴,用液体石蜡覆盖。然后把培养皿放在培养箱(37℃,5% CO2)里至少30分钟。
收集卵母细胞
- hCG处理15-17小时后处死雌性小鼠,取出输卵管。
- 用精细镊子、解剖针刺破输卵管壶腹部,释放出4-6团卵丘卵母细胞复合体(COCs),并把它们拖到CARD MEDIUM(90μL)中(受精培养皿)。
注意: 从处死母鼠到取出输卵管,再将卵丘复合体引入到CARD MEDIUM液滴中,所有操作尽可能在较短的时间内完成(30秒以内)。此外,在进行这一过程时,不要同时处死多个小鼠;相反,在操作下一个母鼠前,尽快地处死小鼠并取出输卵管。
- 受精前将受精培养皿放在培养箱中(37℃,空气中5%的CO2)孵化30-60分钟。
小鼠精子的解冻
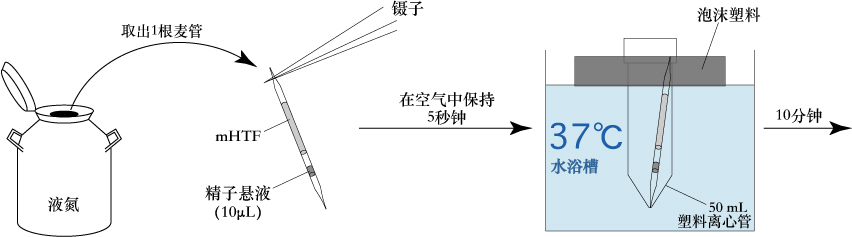
- 从液滴中取出1根麦管,并在空气中曝露5秒钟。
- 完成第一步后,迅速将冷冻麦管放入置于水浴箱(维持37℃)中的离心管内10分钟。
注意: 为了保证冷冻精子的复苏,将含有精子的麦管完全浸入水浴中。此外,冻融小鼠精子对环境变化敏感。如果麦管不在水浴中停留足够长(10分钟),冷冻精子的运动能力就会降低。 - 浸泡10分钟后,将麦管从离心管内取出。
- 用绵纸擦去麦管上的水。
[小鼠精子的解冻]
解冻的精子悬液的转移与预培养
- 拉开连接在麦管连接器上的注射器推筒,在mHTF段剪开。
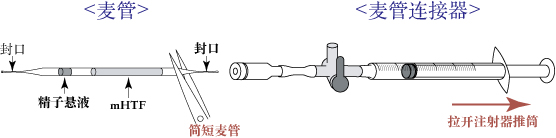
- 将麦管的剪开段插入麦管连接器。
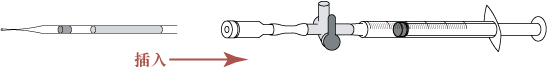
- 由于插入时会造成麦管内压力产生,因此,需转动开关键以减少压力。
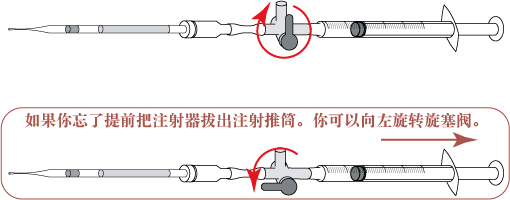
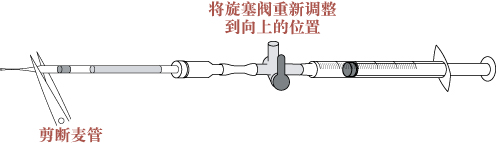
- 将旋塞阀重新调整到向上的位置,然后在封口和精子悬液间剪断。
- 推动注射器推筒,将精子悬液移入精子培养皿中的FERTIUP®(PM) 液滴中,然后将培养皿置于培养箱中30分钟。
注意: 精子在培养基中充分移动前不要随意触动含有冷冻保存精子的培养皿。如果在精子开始移动之前受到搅动,它们将不能完全恢复活力。
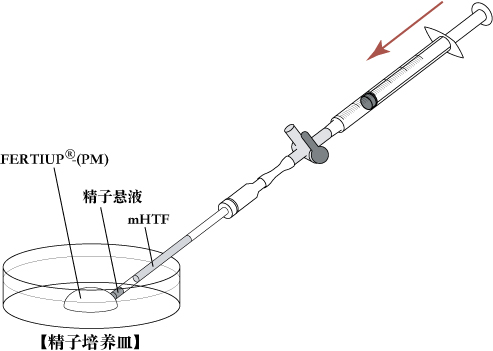
[冻融精子悬液的转移]
人工授精
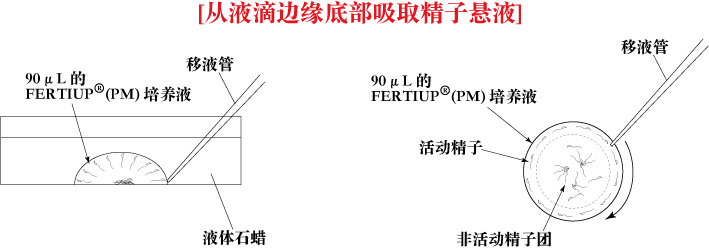
- 采用楔形移液管(QSP移液管,Cat.No.114 Thermo Scientific),从液滴边缘底部吸取10μL预孵育的精子悬液。
注释: 具有高运动性的精子倾向于聚集在液滴的边缘附近。 注释: 每个液滴可以吸取10μL精子悬液3-4次。 - 在每一个含COCs的液滴中添加10μL精子悬液。
注意: 在步骤1和2中尽可能温和地操作移液管。 - 精子和卵子在培养箱(37℃,空气中5%的CO2)中培育3小时。
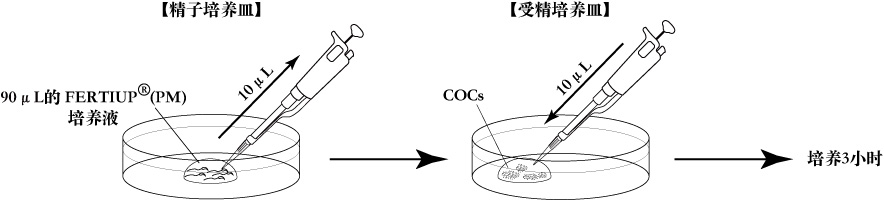
[吸取预培养的精子悬液与卵母细胞授精]
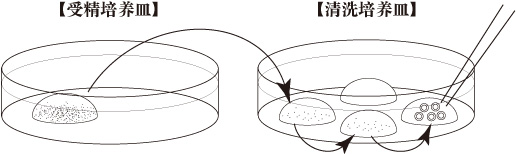
- 培养3小时后,在清洗培养皿中用新鲜的mHTF(80μL)洗卵3次,以避免移植时带有CARD MEDIUM。
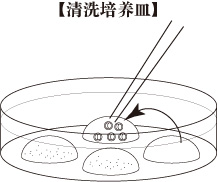
注释: 如果有许多精子附着在卵母细胞透明带上,则可以在清洗前用20μL的移液器和移液管反复抽吸20-30次,以除去卵母细胞上的精子。
- 授精6小时后,在第三滴mHTF液滴中观察授精情况,去除只有一个原核的孤雌卵母细胞。
- 卵母细胞培养过夜,将获得的2-细胞期胚胎转移到第四滴mHTF液滴中。这些胚胎可以被玻璃化冷冻或移植。
参考文献
- Nakagata N., and Takeshima T. 1992. High fertilizing ability of mouse spermatozoa diluted slowly after cryopreservation. Theriogenol. 37: 1283-129.
- Nakagata N., Ueda S., Yamanouchi K., Okamoto K., Matsuda Y., Tsuchiya T., Nishimura M., Oda S., Koyasu K., Azuma S., and Toyoda Y. 1995. Cryopreservation of wild mouse spermatozoa. Theriogenol. 43: 635-643.
- Nakagata N. 1996. Use of cryopreservation techniques of embryos and spermatozoa for production of transgenic (Tg) mice and for maintenance of Tg mouse lines. Lab. Anim. Sci. 46: 236-238.
- Okamoto M., Nakagata N., Ueda O., Kamada N., and Suzuki H. 1998. Cryopreservation of gene disrupted mouse spermatozoa. J. Mamm. Ova. Res. 15: 77-80.
- Takeo T., Hoshii T., Kondo Y., Toyodome H., Arima H., Yamamura KI., Irie T., and Nakagata N. 2008. Methyl-beta-cyclodextrin improves fertilizing ability of C57BL/6 mouse sperm after freezing and thawing by facilitating cholesterol efflux from the cells. Biol Reprod. 78(3): 546-51.
- Takeo T., and Nakagata N. 2010. Combination medium of cryoprotective agents containing L-glutamine and methyl-β-cyclodextrin in a preincubation medium yields a high fertilization rate for cryopreserved C57BL/6J mouse sperm. Lab. Anim. 44(2): 132-7.
- Nakagata N. 2011. Cryopreservation of mouse spermatozoa and in vitro fertilization. Methods Mol Biol. 693: 57-73.
更新记录
- 更新 : 1 May, 2018


