使用超排卵试剂的卵子进行体外受精(获得受精卵)
材料和设备
- 超超排试剂(CARD HyperOva)
- hCG(人绒毛膜促性腺激素,CG-10; Sigma)(37.5IU/mL无菌生理盐水)
- 1mL一次性注射器
- FERTIUP® (前/预培养液: PM; COSMO BIO)
- CARD MEDIUM (COSMO BIO)
- mHTF
- 微量移液器
- 准备培养皿用移液管
- 输精用移液管(吸管 Cat.No.114; Quality Scientific Plastics)
- 塑料培养皿(35mm×10mm Cat.No.430588;CORNING)
- 精细(眼科)剪刀
- 一副5#钟表镊
- 微弹簧剪刀(5mm长刀头)
- 解剖针
- 滤纸
- 胚胎处理用玻璃毛细管
- 显微镜
- 二氧化碳培养箱(37℃,5% CO2、95%空气)
程序
超超数排卵
- 25-31日龄的雌性小鼠(计算出生日期为0天)或成年雌性小鼠(10-12周龄),按0.2mL/只剂量腹腔注射CARD HyperOva诱导排卵。
(CARD HyperOva注射通常在白天,一般在17:00和18:00之间)。 - 48小时后按7.5IU/只剂量腹腔注射人绒毛膜促性腺激素(hCG)。
| 注意: | 25-31日龄的小鼠,超超排诱导与体重有密切关系,建议体重在14-18g。 |
培养皿的准备
- 按照不同需求准备培养皿,并将培养皿置于培养箱(37℃,空气中含 5% CO2)中以达到气平衡。
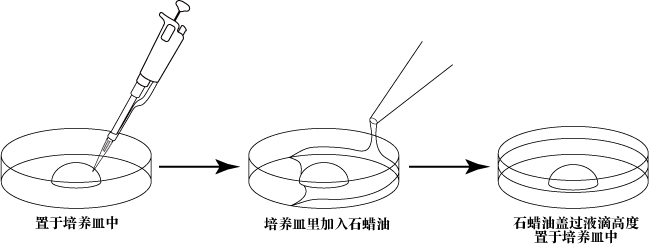
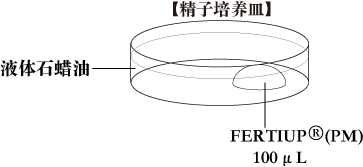
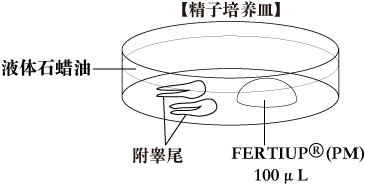
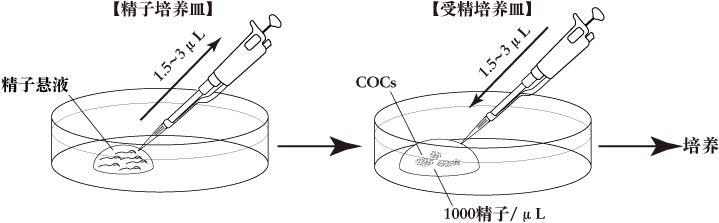
a. 精子培养皿培养皿中滴入1滴(100μL/滴)FERTIUP®(PM),液体石蜡覆盖,收集精液前置于培养箱中孵化30分钟以上。
b. 受精培养皿将1滴(200μL/滴)的CARD MEDIUM放入培养皿中,在收集卵母细胞前10分钟,用液体石蜡覆盖后放入培养箱中培育。
注意: 为使卵母细胞获得适当的效果,制备低密度的CARD MEDIUM。
有关详细资料,请参阅CARD培养液说明手册。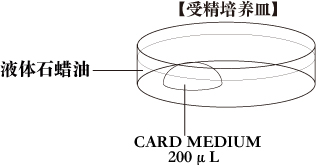
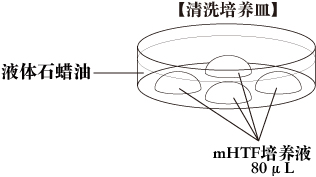
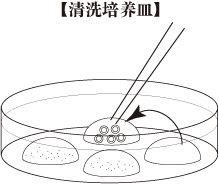
c. 清洗培养皿把4滴(80μL/滴)的mHTF培养液滴在培养皿里,用液体石蜡覆盖。然后把培养皿放在培养箱里至少30分钟。
收集精子
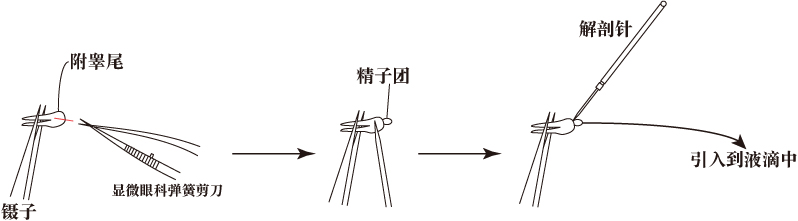
- 处死1或2只成熟的雄性小鼠(3-6月龄),取出附睾尾部,尽可能地避免脂肪、血液和组织液。
- 将附睾尾放在滤纸上,吸取外表的血液和液体。
- 将附睾尾放入含有液体石蜡油的精子培养皿中。
- 用显微镊子夹住附睾,用弹簧剪切开附睾管,然后用解剖针轻轻压压附睾表面,释放出附睾内精子。
- 用解剖针挑起附睾尾部释放出的精子团放入到FERTIUP®(PM)精子预培养液中。
- 受精前将精子放入培养箱(37℃,空气中含5%的CO2)培育60分钟以使精子获能。
| 注意: | 受精率的差别取决于所用的精子。高受精率的精子可以观察到在培养皿边缘的精子具有较高的活力并呈旋涡状运动。相反,精子的活力较低,趋向较低的受精率。 |
收集卵子
- hCG处理15-17小时后处死雌性小鼠。
- 解剖小鼠暴露腹腔。
- 翻开腹腔内消化道,露出子宫、输卵管和卵巢。
- 取出子宫、输卵管和卵巢,并将其放置在无菌滤纸上,轻柔地去除血液和组织液。
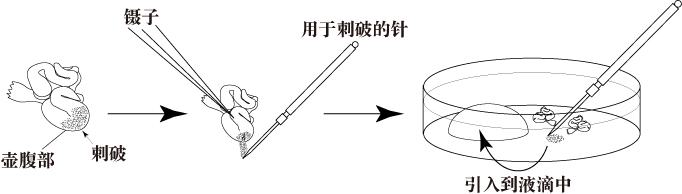
- 将输卵管浸没在含有受精液的液体石蜡中。
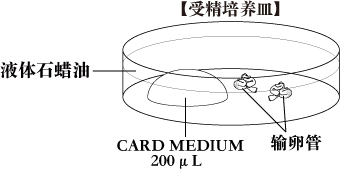
- 用镊子把输卵管沉到培养皿底,然后用解剖针刺破输卵管壶腹部,释放出卵丘卵母细胞复合体(COCs)。并把它们拖到CARD MEDIUM(200μL)中。
注意: 从处死母鼠到取出输卵管,再将卵丘复合体引入到CARD MEDIUM液滴中,所有操作尽可能在较短的时间内完成(30秒以内)。
此外,在进行这一过程时,不要同时处死多个小鼠;相反,在操作下一个母鼠前,尽快地处死小鼠并取出输卵管。
25-31日龄小鼠,一只(2根输卵管)用1滴CARD MEDIUM (200μL);
10-12周龄小鼠,2-3只(4-6根输卵管)用1滴CARD MEDIUM (200μL)。
- 受精前将受精培养皿放在培养箱中(37℃,空气中5%的CO2)孵化20-40分钟。
受精
- 在准备好的精子中,选择一个精子活力和密度最好的。
- 用微量移液器(Pipette Tip Cat.No.114; Quality Scientific Plastics)吸取适量的精子悬液加入到含有COCs的CARD MEDIUM中。
例如,如果受精培养皿中预期的卵母细胞数量是100左右,移入1.5-3μL的精子悬液以使受精培养皿中最终的精子密度达到约1000 /μL。
- 将受精培养皿置于培养箱中(37℃,空气中5%的CO2)。
- 受精2.5小时后,用新鲜的mHTF(80μL)在清洗培养皿中洗卵3次,避免移入CARD MEDIUM。

- 受精后6-6.5小时,观察清洗培养皿中第三个mHTF液滴中的卵母细胞,将有第二极体的卵母细胞转移到第四个mHTF液滴中。
请参考图片中卵母细胞第二极体的例子。
注意: 在这个阶段,仅仅选择受精卵是非常困难的,因为不能清楚地观察到原核。
经过冷冻保存的卵母细胞,观察和选择受精卵是可行的。
- 在此过程中得到的卵母细胞可以被玻璃化冷冻。
参考文献
- Nakagawa Y., Sakuma T., Nakagata N., Yamasaki S., Takeda N., Ohmuraya M., Yamamoto T. 2014 Application of Oocyte Cryopreservation Technology in TALEN-Mediated Mouse Genome Editing. Exp. Anim. 63(3): 349-355.
- Nakagawa Y., Sakuma T., Sakamoto T., Ohmuraya M., Nakagata N., Yamamoto T. 2015 Production of knockout mice by DNA microinjection of various CRISPR/Cas9 vectors into freeze-thawed fertilized oocytes. BMC Biotechnol. 2015 15:33.
- Nakagawa Y., Sakuma T., Nishimichi N., Yokosaki Y., Yanaka N., Takeo T., Nakagata N., Yamamoto T. 2016 Ultra-superovulation for the CRISPR-Cas9-mediated production of gene-knockout, single-amino-acid-substituted, and floxed mice. Biol Open. 5(8): 1142-1148.
- Nakagawa Y., Sakuma T., Nishimichi N., Yokosaki Y., Takeo T., Nakagata N., Yamamoto T. 2017 Culture time of vitrified/warmed zygotes before microinjection affects the production efficiency of CRISPR-Cas9-mediated knock-in mice. Biol Open. 6(5): 706-713.
更新记录
- 更新 : 1 May, 2018
CARD MEDIUM可以使透明带膨胀和变薄,以便精子容易穿透进卵母细胞而受精。
然而,体外受精后,虚弱的透明带不能充分保护卵母细胞因冷冻保存操作所造成的损害。因此,正确使用CARD MEDIUM准备卵母细胞是非常重要的。
按照下面的规则,你可以正确地进行体外受精和超低温保存。
- 按照说明书中的方法准备CARD MEDIUM。
- 使用适当数量的精子进行受精。有关进一步的细节,请参见“受精程序”的第二步。
- 按照说明书中的方法准备CARD MEDIUM。