使用超排卵试剂的卵子进行体外受精(获得2细胞胚到囊胚期胚胎)
材料和设备
- 超超排试剂(CARD HyperOva)
- hCG(人绒毛膜促性腺激素,CG-10; Sigma)(37.5IU/mL无菌生理盐水)
- 1ml一次性注射器
- FERTIUP® (前/预培养液: PM; COSMO BIO)
- CARD MEDIUM (COSMO BIO)
- mHTF
- 微量移液器
- 准备培养皿用移液管
- 输精用移液管(吸管 Cat.No.114; Quality Scientific Plastics)
- 塑料培养皿(35mm×10mm Cat.No.430588;CORNING)
- 精细(眼科)剪刀
- 一副5#钟表镊
- 微弹簧剪刀(5mm长刀头)
- 解剖针
- 滤纸
- 胚胎处理用玻璃毛细管
- 显微镜
- 二氧化碳培养箱(37℃,5% CO2、95%空气)
程序
超超数排卵
- 26-30日龄的雌性小鼠(计算出生日期为0天)按0.1-0.2ml/只剂量腹腔注射CARD HyperOva诱导排卵。
(CARD HyperOva注射通常在白天,一般在17:00和18:00之间)。 - 48小时后按7.5IU/只剂量腹腔注射人绒毛膜促性腺激素(hCG)。
培养皿的准备
- 按照不同需求准备培养皿,并将培养皿置于培养箱(37℃,空气中含 5% CO2)中以达到气平衡。
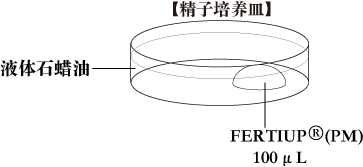
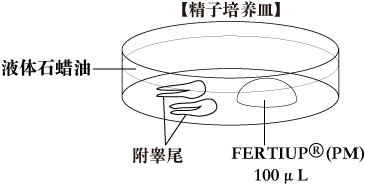
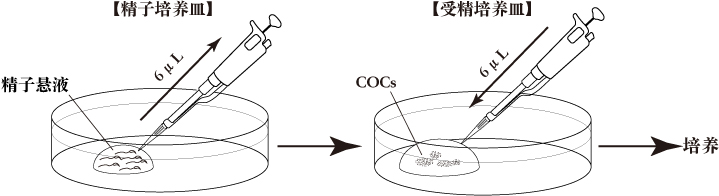
a. 精子培养皿培养皿中滴入1滴(100μL/滴)FERTIUP®(PM),液体石蜡覆盖,收集精液前置于培养箱中孵化30分钟以上。
b. 受精培养皿将1滴(200μL/滴)CARD MEDIUM滴入培养皿中,在收集卵母细胞前10分钟,用液体石蜡覆盖后放入培养箱中培育。
注意: 有三种不同的方法来准备CARD MEDIUM,这取决于是使用新鲜的、冻融的还是低温冷藏的精子来进行体外受精。
请参阅CARD MEDIUM说明手册。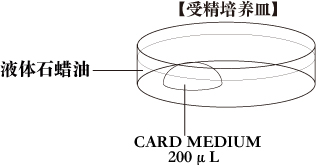
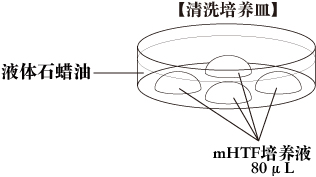
c. 清洗培养皿把4滴(80μL/滴)的mHTF培养液滴在培养皿里,用液体石蜡覆盖。然后把培养皿放在培养箱里至少30分钟。
收集精子
- 处死1或2只成熟的雄性小鼠(3-6月龄),取出附睾尾部,尽可能地避免脂肪、血液和组织液。
- 将附睾尾放在滤纸上,吸取外表的血液和液体。
- 将附睾尾放入含有液体石蜡油的精子培养皿中。
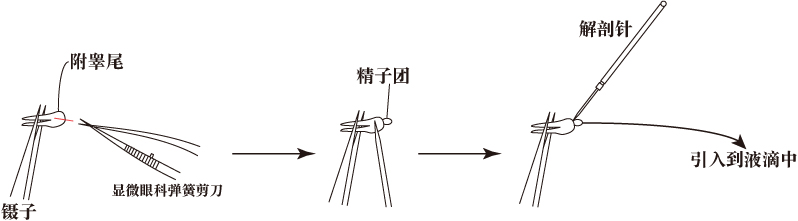
- 用显微镊子夹住附睾,用弹簧剪切开附睾管,然后用解剖针轻轻压压附睾表面,释放出附睾内精子。
- 用解剖针挑起附睾尾部释放出的精子团放入到FERTIUP®(PM)精子预培养液中。
- 受精前将精子放入培养箱(37℃,空气中含5%的CO2)培育60分钟以使精子获能。
| 注意: | 受精率的差别取决于所用的精子。高受精率的精子可以观察到在培养皿边缘的精子具有较高的活力并呈旋涡状运动。相反,精子的活力较低,趋向较低的受精率。 |
收集卵子
- hCG处理15-17小时后处死雌性小鼠。
- 解剖小鼠暴露腹腔。
- 翻开腹腔内消化道,露出子宫、输卵管和卵巢。
- 取出子宫、输卵管和卵巢,并将其放置在无菌滤纸上,轻柔地去除血液和组织液。
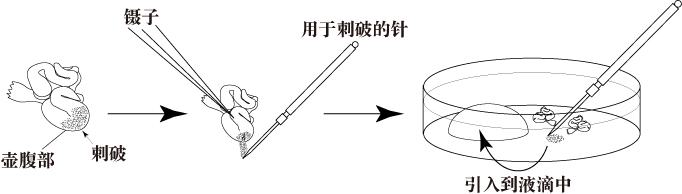
- 将输卵管浸没在含有受精液的液体石蜡中。
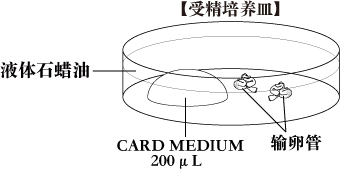
- 用镊子把输卵管沉到培养皿底,然后用解剖针刺破输卵管壶腹部,释放出卵丘卵母细胞复合体(COCs)。并把它们拖到CARD MEDIUM(200μL)中。
注意: 从处死母鼠到取出输卵管,再将卵丘复合体引入到CARD MEDIUM液滴中,所有操作尽可能在较短的时间内完成(30秒以内)。
此外,在进行这一过程时,不要同时处死多个小鼠;相反,在操作下一个母鼠前,尽快地处死小鼠并取出输卵管。
每只小鼠(2根输卵管)用1滴CARD MEDIUM (200μL)。
- 受精前将受精培养皿放在培养箱中(37℃,空气中5%的CO2)孵化30-60分钟。
受精
- 用微量移液器(Pipette Tip Cat.No.114; Quality Scientific Plastics)吸取适量(通常约6μL)的精子悬液加入到含有COCs的CARD MEDIUM中。
- 将受精培养皿置于培养箱中(37℃,空气中5%的CO2)。
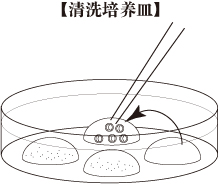
- 受精3小时后,在清洗培养皿中用新鲜的mHTF(80μL)洗卵3次,避免移入CARD MEDIUM。

- 受精后6小时,观察清洗培养皿中第三个mHTF液滴中的卵母细胞,剔除所有只有一个原核的孤雌卵母细胞。
- 卵母细胞的培养过夜后,将得到的2-细胞期胚胎移到一个有4个mHTF液滴的清洗培养皿。这些胚胎可以被玻璃化冷冻,也可被移植到受体母鼠,或培养到囊胚期。
| 注意: | 在这个阶段,确定和剔除所有孤雌卵母细胞是很重要的。 如果你不在这个阶段剔除这些孤雌卵母细胞,第二天它们将发育到2-细胞期,这时候就难以区分受精卵母细胞和孤雌卵母细胞。 |
[受精、未受精和孤雌卵母细胞的示意]
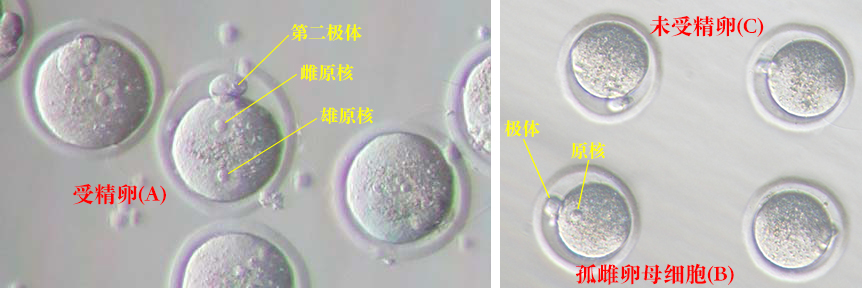

| 注意: | 受精卵既有雄核,又有雌核(A). 另一方面,孤雌卵母细胞只有一个原核(B),而未受精卵没有原核(C)。 |
参考文献
- Takeo T., Hoshii T., Kondo Y., Toyodome H., Arima H., Yamamura KI., Irie T., and Nakagata N. 2008. Methyl-beta-cyclodextrin improves fertilizing ability of C57BL/6 mouse sperm after freezing and thawing by facilitating cholesterol efflux from the cells. Biol Reprod. 78(3): 546-51.
- Takeo T., and Nakagata N. 2010. Combination medium of cryoprotective agents containing L-glutamine and methyl-β-cyclodextrin in a preincubation medium yields a high fertilization rate for cryopreserved C57BL/6J mouse sperm. Lab. Anim. 44(2): 132-7.
- Takeo T., and Nakagata N. 2011. Reduced glutathione enhances fertility of frozen/thawed C57BL/6 mouse sperm after exposure to methyl-beta-cyclodextrin. Biol Reprod. 85(5):1066-1072.
- Takeo T., Nakagata N. 2015 Superovulation Using the Combined Administration of Inhibin Antiserum and Equine Chorionic Gonadotropin Increases the Number of Ovulated Oocytes in C57BL/6 Female Mice.
PLoS One. 2015 May 29;10(5):e0128330. doi: 10.1371/journal.pone.0128330.
更新记录
- 更新 : 1 May, 2018